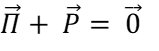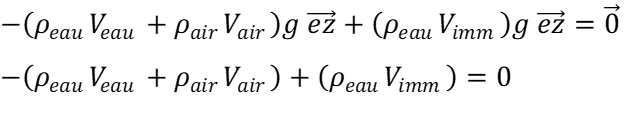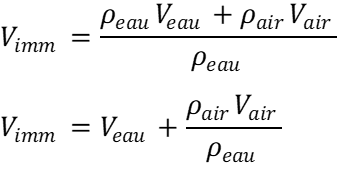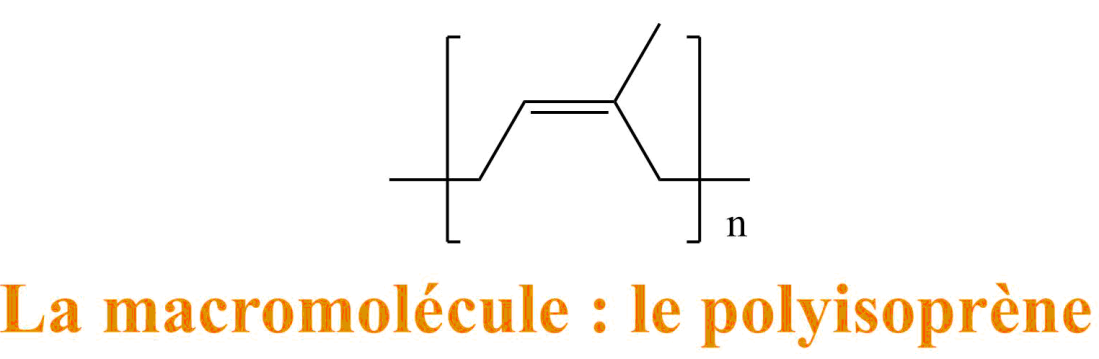* Tg : glass temperature (anglais), température de transition vitreuse en français
Bien le bonjour à tous 🙂
Peut-être avez-vous profité de votre été pour voir le dernier Pixar/Disney. Un film super consacré à Elastigirl, dont le pouvoir est d’avoir un corps élastique. Pour les vieux comme moi c’est le même pouvoir que Red Richard dans les quatre fantastiques ou encore pour le pouvoir de Luffy dans one piece.
Et quel est le plus grand point faible des Hommes élastiques ? Baisser la température !
C’est en effet ce qui se passe dans les indestructibles 2. Elen Paar se fait immobiliser par une machine qui abaisse sa température.

Cette technique est vielle comme le monde puisque le docteur Fatalis utilise la même contre Mr Fantastique, dans le film les quatre fantastiques de 2005.

Mais pourquoi donc baisser la température modifie t-il ainsi le caoutchouc ? Que se passe t-il au niveau des molécules ? Un petit voyage au sein des polymères de caoutchouc nous attend.
Le Caoutchouc : qui que quoi ?

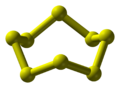
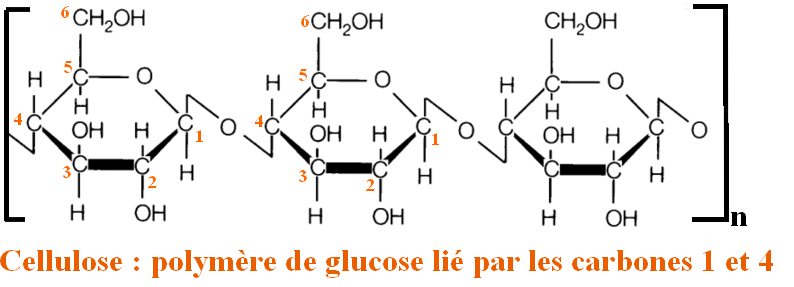
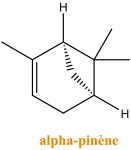
Le caoutchouc est un polymère, c’est à dire un ensemble d’immense molécules (Macromolécules) que l’on représente souvent par de longs fils : comme des spaghettis. Pour le caoutchouc ces longs fils sont constitués de la répétition d’un même motif : qui provient d’une petite molécule de départ (un monomère) : cis-1,4-isoprène.
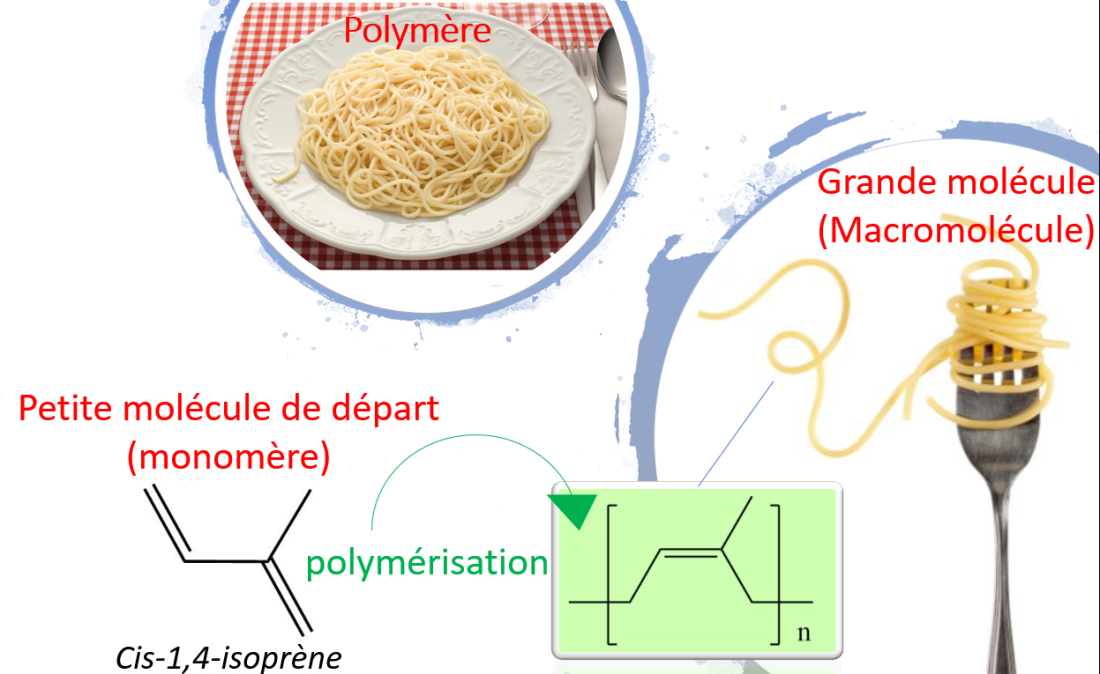
Mais qu’est ce qui fait du caoutchouc cette rock star internationale, présente à la fois dans les voitures, les chaussures et mêmes dans les carburants de fusées ?
Au début le caoutchouc résistait mal aux écarts de températures, en hiver il était cassant et en été il collait. Et c’est en 1842 que Charles Goodyear invente la vulcanisation du caoutchouc
Le principe est simple : on ajoute du soufre au polymère et l’on va ainsi créer des liaisons soufre entre les spaghettis.
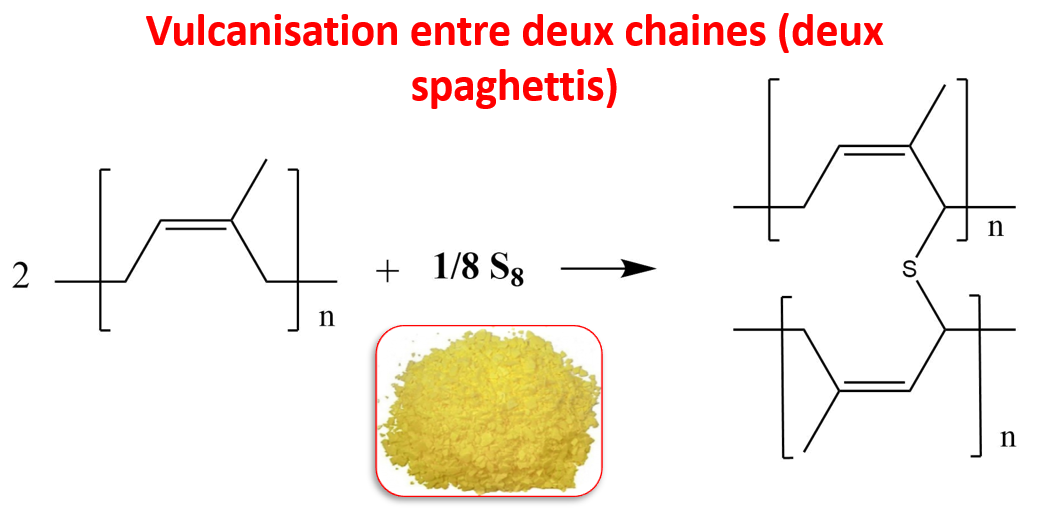
C’est grâce à la vulcanisation que le caoutchouc possède des propriétés élastiques si intéressantes. Avant la vulcanisation, le caoutchouc ressemble un peu à un chewing-gum déjà mastiqué (encore une métaphore sur la nourriture ^^) : il est étirable mais pas élastique. Fun fact : la présence de tous ces ponts soufre entre les chaîne nous donne une seule immense molécule ! Et oui quand vous prenez une balle de caoutchouc dans vos mains vous possédez une seule molécule :).
Les ponts soufre vont jouer un peu le rôle de ressort, lorsque l’on tirera sur le polymère, les macromolécules vont glisser les unes par rapports aux autres mais les ponts soufre qui les relient vont avoir tendance à les ramener dans leur état d’origine. : c’est l’élasticité !
Bon maintenant on connaît bien le matériau qui constitue Elastigirl, mais comment expliquer cet aspect très cassant à basse température (même pour un caoutchouc vulcanisé) ?
Comment casser du caoutchouc ?
Que se passe t-il quand on fait varier la température de n’importe quel solide ?
Dans un solide les molécules bougent très peu, elles sont fixées et ont beaucoup d’interactions entre elles (interactions dites de Van der Waals ou liaisons hydrogène) ! Puis dès que l’on augmente la température on donne de l’énergie aux molécules qui vont se mettre à bouger de plus en plus : on passe alors à l’état liquide et puis gazeux dans lequel les molécules ont très peu d’interactions entre elles car elles sont beaucoup plus loin les unes des autres.
L’idée clé c’est que chauffer c’est donner de l’énergie aux molécules pour combattre les interactions attractives qu’elles ont entre elles. Plus on chauffe plus on les sépare.

Pour un polymère l’idée va être la même, maisle nombre d’interactions entre les macromolécules (spaghettis) est beaucoup plus grand que pour les molécules classiques. Il va falloir apporter beaucoup d’énergie ! Ainsi pour un polymère il est impossible d’avoir un état gazeux, l’énergie à fournir serait beaucoup trop importante, résultat on carbonise le polymère bien avant !
Et oui vous ne pourrez jamais avoir du plastique gazeux, ni du caoutchouc !

Ainsi les transitions de phases pour un polymère vont être très différentes de celles pour une molécule simple.
Comme pour les petites molécules lorsque l’on va chauffer un polymère, les macromolécules le constituant vont se mettre à bouger, glisser les unes par rapport aux autres.
Pour les polymères tel que le caoutchouc : les élastomères, deux états existent. Un état vitreux et un état caoutchoutique.
Petite expérience fictive ^^ : partons de notre caoutchouc à température ambiante, et on le refroidit petit à petit. Les macromolécules vont alors de moins en moins bouger entre elles, et on va finir par descendre en dessous d’une température Tg (glass temperature) : température de transition vitreuse. Les macromolécules sont alors peu mobiles et ont donc beaucoup d’interactions entre elles : c’est l’état vitreux ou amorphe.

Dans l’état vitreux le polymère se présente sous la forme d’un verre, c’est à dire un solide dur et cassant…comme du verre ^^.
Au-dessus de la température de transition vitreuse le caoutchouc est dans son état caoutchoutique : et c’est cet état qui nous intéresse généralement.
En quelque sorte à Tg le polymère passe d’un état « spaghettis cuits congelés » à un état « spaghettis cuits décongelés ».
La particularité du caoutchouc (et des élastomères) c’est que à température ambiante on est à T>Tg. Ils sont donc caoutchoutiques à température ambiante.
Et pour Elastigirl ?
Pour immobiliser un Homme caoutchouc on peut donc abaisser sa température, ainsi on descend en dessous de sa température de transition vitreuse et il devient cassant :), car les macromolécules le constituant sont très figées et donc se cassent quand on exerce une traction dessus.
Petite vidéo trouvée sur YouTube pour montrer l’effet d’une faible température (avec de l’azote liquide) sur une balle de caoutchouc.
Bibliographie
- http://www.mediachimie.org/ressource/mat%C3%A9riaux-et-chimie-supramol%C3%A9culaire
- https://www.youtube.com/watch?v=n2zOdsxC_eo
- wikipédia : caoutchouc, polymères, transition vitreuse
- Chimie tout en un PC/PC*, Bruno Fosset, édition Dunod